Основные тенденции развития промышленного органического синтеза. Современные тенденции развития промышленности нефтехимического синтеза и эффективности использования альтернативных источников углеводородного сырья Альтернативное сырье органического и нефт
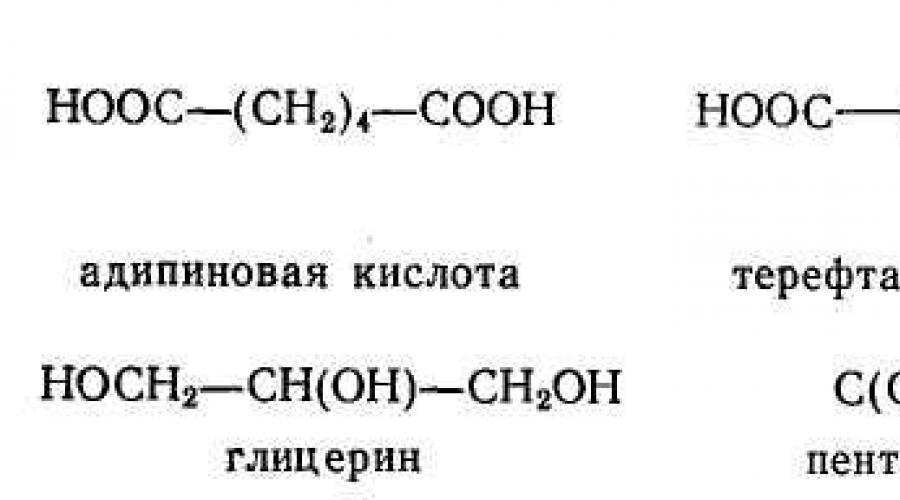
Читайте также
Продукты этой отрасли промышленности отличаются большим многообразием строения, свойств и областей применения. Это различные углеводороды, хлор- и фторпроизводные, спирты и фенолы, простые эфиры, альдегиды и кетоны, карбоновые кислоты и их производные (сложные эфиры, ангидриды, нитрилы и др.), амины и нитросоединения, вещества, содержащие серу и фосфор, и т. д. По назначению все они подразделяются на две группы: промежуточные продукты для синтеза других веществ в этой же или других отраслях органической технологии и продукты целевого применения в разных отраслях народного хозяйства.
Промежуточные продукты. Многие вещества, почти не имеющие целевого применения в народном хозяйстве, производят главным образом для того, чтобы на их основе синтезировать другие ценные соединения. Это - промежуточные продукты органического синтеза. Так, основную массу 1,2-дихлорэтана производят для последующей переработки в винилхлорид, окись этилена для получения моноэтиленгликоля.
Роль, масштабы производства и ассортимент промежуточных продуктов очень велики, так как синтез органических соединений протекает через ряд промежуточных стадий.
Мономеры и исходные вещества для полимерных материалов. Их производство занимает одно из самых важных мест в основном органическом и нефтехимическом синтезе, обеспечивающем сырьем промышленность пластических масс, синтетического каучука, синтетических лаков, клеев, пленочных материалов, волокон.
Все синтетические полимеры получают двумя основными способами-полимеризацией и поликонденсацией. Для первой из этих реакций требуются мономеры, т. е. вещества, способные под влиянием тепла, света, облучения или катализаторов соединяться друг с другом без выделения каких-либо низкомолекулярных соединений и давать длинные цепи полимера с теми же элементарными звеньями, как в исходном мономере: полимеризация этилена.
Из мономеров отметим моноолефины (этилен, пропилен, изобутен), диены (бутадиен-1,3 и изопрен, являющийся основой при получении каучука) и стирол.
При поликонденсации исходные вещества должны иметь не менее двух функциональных групп, способных реагировать друг с другом. Так, при образовании полиэфиров взаимодействуют гидрокси- и карбокси-группы:
Исходные вещества для поликонденсационных процессов принадлежат к разнообразным ди- и полифункциональным соединениям. Это - фосген СОС1 2 , дикарбоновые кислоты, их ангидриды и хлорангидриды, а также ряд поликарбоновых кислот и их ангидридов, гликоли и полигликоли, диамин:

При реакциях полимеризации и поликонденсации очень важное значение имеет чистота реагентов. Содержащиеся в них примеси могут ингибировать реакцию или обрывать рост цепи молекулы при полимеризации, нарушать нужное соотношение исходных веществ при поликонденсации, приводя к полимерам со слишком малой молекулярной массой и пониженными техническими показателями. В этом отношении к продуктам основного органического и нефтехимического синтеза предъявляют очень высокие требования, причем чистота мономеров нередко должна соответствовать содержанию основного вещества 99,8- 99,9 % и более (изобутилен полимеризационной чистоты).
Пластификаторы и другие вспомогательные вещества для по лимерных материалов. В производстве синтетических полимеров и изделий из них наряду с мономерами и исходными веществами большую роль играют пластификаторы и другие вспомогательные вещества, которые способствуют процессу синтеза или улучшают технические свойства получаемых полимеров и изделий.
Пластификаторами (или мягчителями) называют вещества, добавляемые к некоторым полимерам в количестве до 30-40 % для улучшения их пластических, эластических свойств. Это необходимо, во-первых, при переработке полимеров прессованием, вальцеванием и другими методами, для чего полимеры должны быть достаточно текучими. Одной из важнейших групп пластификаторов являются высококипящие сложные эфиры, например дибутил- и диоктилфталаты, некоторые эфиры высших спиртов с дикарбоновыми кислотами или высших карбоновых кислот с двухатомными спиртами, алкилароматические углеводороды, низшие полиолефины и др.
Стабилизаторами называют вещества, повышающие стойкость полимеров и резин к окислительному старению. В качестве стабилизаторов применяются алкилфенолы, ароматические диамины.
Синтетические поверхностно-активные и моющие вещества . Поверхностно-активные свойства появляются у органических веществ, содержащих в молекуле гидрофобную группу и наряду с ней гидрофильную (полярную) группировку, способную к сольватации водой. В обычном мыле - натриевой соли стеариновой или пальмитиновой кислоты RCOONa роль этих групп выполняют соответственно длинная углеводородная цепь и карбоксилатная группа.
Ввиду такой особенности строения поверхностно-активное вещество (ПАВ) концентрируется на поверхности раздела фаз, ориентируясь своей гидрофобной группой к масляно-жировому компоненту системы, а гидрофильной - к воде. В результате значительно уменьшается поверхностное натяжение, что способствует хорошему смачиванию материала и переходу загрязнений в воду. Поверхностно-активные вещества обладают также эмульгирующими и диспергирующими свойствами, пенообразующей способностью.
Поверхностно-активные и моющие вещества особенно широко применяют в быту для стирки тканей и изделий из них и чистки различных предметов. В текстильной промышленности их используют для обработки тканей перед крашением, в машиностроении и металлообработке - при резании металлов, для очистки деталей от масел и механических загрязнений, в парфюмерной промышленности - как компоненты туалетного мыла и косметических средств. В химической технологии они служат эмульгаторами при гетерофазных реакциях (в особенности при эмульсионной полимеризации).
Поверхностно-активные и моющие вещества разделяют на ионогенные и неионогенные, отличающиеся наличием или отсутствием групп, способных к диссоциации в водных растворах. Ионогенные вещества в свою очередь бывают анионо- и катионоактивными, в которых поверхностно-активные свойства определяются соответственно анионом или катионом, образующимся при диссоциации.
К анионоактивным веществам относятся наиболее важные промышленные моющие вещества, в том числе мыла - обычное и получаемое из синтетических жирных кислот (активная часть молекулы - группа RCOO~). Такие ПАВ имеют щелочную реакцию и способствуют разрушению тканей, дают с солями магния и кальция нерастворимые соли, что снижает их моющие свойства в жесткой воде, проявляют активность лишь при значительной концентрации в воде. Эти недостатки в значительной степени отсутствуют у современных синтетических анионоактивных веществ, большинство которых представляют собой натриевые соли органических сульфокислот и кислых эфиров серной кислоты. К их числу принадлежат алкиларенсульфонаты RC 6 H4SO 2 ONa, алкилсульфонаты RSO 2 ONa и алкилсульфаты ROSO 2 ONa с алкильными группами С 12 -C 18 .
Катионоактивные моющие вещества имеют сравнительно небольшое практическое значение. Они чаще всего представляют собой соли аминов или четвертичных аммониевых оснований, например соль алкилбензилтриметиламмония + C1-
В последние годы начали все шире использовать неионогенные моющие вещества. Их синтезируют из этиленоксида и различных органических соединений - алкилфенолов, карбоновых кислот, спиртов, аминов и других веществ с активными атомами водорода. Гидрофильные свойства им придает оксиэтильная цепь, например R(OCH 2 CH 2) n OH.
Поскольку поверхностно-активные вещества после их употребления попадают в сточные воды, важным требованием является высокая степень их биоразлагаемости, т. е. способности к окислению в безвредные вещества под влиянием микроорганизмов, находящихся в естественных водоемах. Это налагает определенные ограничения на строение входящего в состав ПАВ углеводородного остатка, который не должен быть разветвленным.
Синтетическое топливо, смазочные масла и добавки к ним. Многие продукты основного органического и нефтехимического синтеза имеют важное значение в автомобильном транспорте, авиации, ракетной технике и других областях. К ним относятся синтетические моторные и ракетные топлива, смазочные масла, присадки, улучшающие свойства топлив и масел, антифризы, препятствующие замерзанию охлаждающих жидкостей, тормозные и гидравлические жидкости.
В качестве высокооктановых компонентов моторных топлив применяют изопарафины, изопропилбензол С 6 Н 5 СН(СН 3)2, трет-бутилметиловый эфир (СН 3)зСОСН 3 и др.
Синтетические смазочные масла принадлежат к нескольким группам органических соединений, из которых важнейшими являются следующие: синтетические углеводороды (низшие полимеры олефинов и алкилированные ароматические углеводороды); сложные эфиры двухосновных карбоновых кислот и высших одноатомных спиртов, а также высших монокарбоновых кислот и многоатомных спиртов.
Применяют различные присадки, повышающие эксплуатационные качества топлив и масел и их стабильность при хранении. Антиокислительные присадки к топливу и смазочным маслам, а также к полимерам (например, алкилированные фенолы) замедляют цепные реакции автоокисления. Другие присадки понижают температуру застывания масел (депрессоры), улучшают их вязкостные свойства (вязкостные присадки), препятствуют коррозии металлов (ингибиторы коррозии) и т. д.
Растворители и экстрагенты . Синтетические растворители должны, кроме того, был дешевыми, легко доступными и мало токсичными. Температура кипения их не должна быть слишком низка во избежание чрезмерных потерь и не должна быть слишком высока, чтобы их можно было регенерировать путем отгонки. В ряде случаев удалось синтезировать растворители с пониженной пожароопасностью и даже совсем негорючие.
В настоящее время растворители и экстрагенты применяют очень широко: для выделения ароматических углеводородов из продуктов переработки нефти, в процессах азеотропной и экстрактивной перегонки, для извлечения жиров и масел из природных веществ. В химической промышленности их часто используют, например, для очистки и перекристаллизации, как абсорбенты газов и паров (ацетилена и летучих веществ, уносимых газами), при синтезе полимеров (особенно в лакокрасочной промышленности). В машиностроении и металлообработке рас творителями обезжиривают и очищают детали. В сельском хозяйстве растворители нужны при употреблении пестицидов.
Синтетические растворители и экстрагенты могут принадлежать к различным группам органических соединений. Это - бензол, хлорпроизводные углеводородов (тетрахлорметан, дихлорметан, три- и тетрахлорэтилен), спирты (этанол, пропанол, бутанолы, пентанолы), целлозольвы, простые эфиры (диэтиловый, диизо-пропиловый и высшие), кетоны (ацетон, метилэтилкетон, изобутилметилкетон), сложные эфиры (этил-, бутил- и пентилаце-тат), а также диметилформамид HCON(CH 3)2, диметилсульф-оксид (CH 3) 2 SO и др.
Пестициды и химические средства защиты растений . Пестицидами (или ядохимикатами) называют вещества, обладающие токсичными свойствами по отношению к тем или иным живым организмам - от бактерий и грибков до растений и вредных животных. Значительная часть пестицидов применяется в сельском хозяйстве в качестве химических средств защиты растений; кроме того, их используют в быту, для борьбы с распространителями болезней и эпидемий, для уничтожения вредителей на складах, в трюмах кораблей, в жилых зданиях и т. д. Применение пестицидов в сельском хозяйстве позволяет избежать многих болезней полевых и садовых культур и значительно уменьшить потери урожая. В связи с этим химические средства защиты растений стали не менее важным фактором в повышении урожайности, чем химические удобрения.
СЫРЬЕ ДЛЯ НЕФТЕХИМИЧЕСКОГО СИНТЕЗА И ЕГО ПОДГОТОВКА Сырье для нефтехимического синтеза
из "Основы технологии нефтехимического синтеза"
Развитие нефтехимической промышленности связано с использованием в качестве сырья низкомолекулярных олефинов - этилена, пропилена, изобутилена и н-бутилена. Позднее химической переработке стали подвергаться амилены, а затем метан, этан, пропан, бутаны и пентан. Большое значение приобретают промышленные синтезы на основе ацетилена, надежным источником для которого является метан.В настоящее время для нефтехимического синтеза широко применяются также и жидкие углеводороды нефти. Из года в год увеличивается потребление бензола, толуола, ксилолов и нафталина для синтеза моющих веществ, синтетических волокон, ядохимикатов и др. Все в больших масштабах используют твердые парафины в процессах окисления с целью получения синтетических жирных кислот и спиртов, а также мягкие (жидкие) парафины. Парафины применяются также для сульфоокис-ления и сульфохлорирования. При крекинге твердых парафинов получают а-олефины, из которых производят вторичные алкилсульфаты - моющие вещества.
Среди нафтеновых углеводородов особое место занимает циклогексан, используемый как полупродукт и как растворитель в производстве синтетического волокна и пластических масс. Применение циклогексана в этих целях стимулировало увеличение его производства.
При разработке газовых месторождений природные газы являются целевым продуктом. Природный газ состоит в основном из метана и некоторого количества других углеводородных газов, а также примеси инертных и редких газов (см. табл. 0.2). Добываются газы и из газоконденсатных месторождений - глубоко залегающих газовых месторождений с высоким давлением в пласте. После снижения давления такие газы выделяют конденсат- жидкие углеводороды, выкипающие до 300 °С и выше, которые также могут быть использованы как химическое сырье. Например, Карадагский конденсат имеет н. к. 57°С, содержит фракции до 100°С-14%, до 150°С -40%, до 200 С -57% и к. к. 340° с. Карадагский газ содержит до 168 г конденсата на 1 Л1 газа, газы Саратовского газоконденсатного месторождения содержат 45 г конденсата на 1 м.
Можно осуществлять химическую переработку и газов коксования, содержащих до 2,5% олефинов. Генераторные газы и газы сланцепереработки можно применять в процессах с использованием водорода либо для синтезов на основе окиси углерода и водорода эти газы содержат до 63% водорода, 15% окиси углерода, 12% метана и незначительное количество (0,5%) олефинов.
Нефтехимический синтез располагает многообразными возможностями химических превращений углеводородов. Химической переработке подвергаются индивидуальные углезодороды или узкие фракции, которые выделяют из природных и попутных газов, газов нефтепереработки, из жидких продуктов термокаталитических процессов переработки нефтяного сырья. Ниже рассматриваются основные превращения индивидуальных углеводородов.
Мета является составной частью попутных, природных и искусственных газов. В настоящее время разработаны и внедрены в промышленность различные методы его химической переработки. Одним из перспективных процессов является окисление метана с образованием формальдегида, метанола и ацетальдегида.
При пиролизе и дегидрировании метана можно получать ацетилен, сажу и водород. При конверсии метана водяным паром или водяным паром и кислородом получают синтез-газ (СО-Ь -ЬНг) -сырье, используемое для дальнейшего органического синтеза, а также в отдельности чистую окись углерода и водород, которые применяют для процессов гидрирования и синтеза аммиака. Аммиак идет на синтез мочевины, представляющей ценный продукт для производства пластмасс и эффективное удобрение.
При хлорировании метана в промышленных масштабах полу, чают хлористый метил, хлористый метилен, хлороформ и четыреххлористый углерод. При нитровании метана образуется нитрометан, используемый в качестве растворителя при изготовлении различных лаков.
Схема основных направлений переработки метана показана на рис. I. I.
При пиролизе этана образуется этилен-исходное сырье для синтеза окиси этилена, этилового спирта, полиэтилена, стирола и других продуктов (рис. I. 2). При окислительном пиролизе образуется ацетилен, при хлорировании получают хлористый этил, применяемый для изготовления тетраэтилсвинца, спиртов, пластмасс, а при нитровании - нитроэтан и нитрометан, широко употребляемые в качестве растворителей.
Пропан. При окислении пропана получают ацетальдегид, формальдегид, уксусную кислоту, ацетон. При пиролизе пропана образуется этилен и пропилен. Наряду с метаном и этаном пропан можно использовать и для получения ацетилена (см. рис. I. 2). При нитровании пропана получается нитрометан, нитроэтан и нитро пропан. Продукты хлорирования пропана пока не имеют промышленного значения.
ТОПЛИВ. При дегидрировании изобутана образуется изобутилен - сырье для получения бутилкаучука, полиизобутилена, полимербензина кроме того, изобутан является широко распространенным алкилирующим агентом.
Этилен. В нефтехимических синтезах в наибольших количествах используется этилен. Из него получают этиловый спирт, окись этилена, полиэтилен, стирол, ди.хлорэтан и другие продукты. Основная масса этилена в ближайшие годы будет перерабатываться в полиэтилен (рис. I. 4).
Пропилен. Пропилен служит сырьем для синтеза полипропилена, изопропилового спирта, изопропилбензола, на основе которого получают фенол и ацетон, глицерина и эпихлоргидрина, тетрамеров пролилена для моющих веществ, метилстирола, окиси пропилена, акролеина, амилового спирта и других продуктов (рис. I. 5). В последнее время приобретает значение промышленный синтез акрилонитрила из пропилена и аммиака. Выработка изопропилбензола возрастает из года в год и будет расти и дальше, так как на его основе получают самый дешевый фенол, потребности в котором очень велики.
Продукты, получаемые на основе пропилена, бключая полипропилен, можно вырабатывать на нефтеперерабатывающих заводах, располагающих большими ресурсами пропилена в виде пропан-пропиленовой фракции.
Бутилены. Бутилены играют весьма важную роль в нефтехимической промышленности в основном они используются для синтеза каучуков. Наиболее массовым сырьем для производства синтетических каучуков являются бутилен-1 и бутилен-2 - промежуточные продукты, образующиеся при производстве бутадиена. Сополимеризацией изопрена и изобутилена получают специальный сорт синтетического каучука - бутил-каучук.
На основе бутиленов бутан-бутиленовой фракции крекинг-газов осуществляют промышленное производство алкилата - высокооктановой добавки к моторному топливу. В промышленном масштабе выпускают низкомолекулярный и высокомолекулярный полиизобутилены, применяемые как загустители для нефтяных смазочных масел и для других целей. Бутилены используют также для промышленного производства вторичных и третичных бутиловых спиртов и других продуктов (рис. I. 6).
Ацетилен. Ацетилен служит исходным сырьем для синтеза большого числа продуктов нефтехимической промышленности. Растущий из года в год спрос на ацетилен вызвал необходимость разработки новых экономичных способов его получения. В настоящее время в промышленности освоен способ производства ацетилена из природного газа - термоокислительным пиролизом метана, т. е. расщеплением метана за счет сжигания части газа с кислородом, подаваемым в процесс.
Основным углеводородным сырьем для нефтехимических синтезов являются смеси газообразных, жидких и твердых углеводородов.
Природные газы состоят в основном из метана и других насыщенных углеводородов; в них также присутствуют инертные газы (азот, диоксид углерода) и редкие газы (аргон, ксенон). Природные газы добывают при разработке газовых и конденсатных месторождений.
Попутные нефтяные газы получают как побочный продукт при добыче нефти. Эти газы растворены в пластовой нефти и при ее добыче выделяются вследствие снижения давления. Попутный нефтяной газ состоит из насыщенных углеводородов от метана до пентанов и обычно содержит некоторое количество инертных газов; попутные газы некоторых месторождений содержат также свободный сероводород. Как правило, попутные нефтяные газы содержат значительные количества углеводородных компонентов – этана, пропана и бутанов, являющихся ценным сырьем для нефтехимии.
Газы нефтепереработки образуются в процессах крекинга, коксования, риформинга; их также отбирают на установках стабилизации и прямой перегонки нефти. В зависимости от характера этих процессов состав получаемых газов меняется в широких пределах. Например, газы каталитического риформинга содержит до 60% водорода; остальное – насыщенные углеводороды. Газы крекинга и коксования состоят из насыщенных и ненасыщенных углеводородов.
Газы стабилизации нефти отличаются высоким содержанием пропана, бутана, пентана и изопентана, что делает их ценным сырьем для получения бутадиена и изопрена.
Газовые бензины выкипают в интервале 30-120 0 С; они содержат бутан, пентан, изопентан, а также углеводороды С 6 и С 7 нормального строения и изостроения.
Газовые конденсаты выкипают в интервале 40-360 0 С. В них содержится 15-30% ароматических углеводородов; 25-40% нафтенов и 20-60% парафинов (в зависимости от месторождения).
Жидкие дистилляты и нефтепродукты , образующиеся при различных процессах переработки нефти, тоже используют как исходное сырье в нефтехимических процессах, точнее как источник для выделения тех или иных групп углеводородов. Так, из продуктов каталитического риформинга выделяют ароматические углеводороды, из продуктов термического и каталитического крекинга - олефины, из продуктов депарафинизации дизельного топлива – парафины.
Углеводороды, выделяемые из углеводородного сырья, имеют большое практическое значение. Например, метан природного газа используют как топливо и сырье для получения водорода, ацетилена, аммиака и метанола. Этан служит сырьем для процессов пиролиза с целью получения этилена; газовые конденсаты – сырьем для получения бутадиена, изопрена, ароматических углеводородов.
v Требования к углеводородному сырью
К углеводородному сырью для нефтехимических процессов обычно предъявляют значительно более жесткие требования, чем к сырью для процессов переработки нефти.
Реакции, используемые в нефтехимическом синтезе, большей частью каталитические или радикально-цепные, причем для получения требуемых продуктов необходима высокая селективность катализатора, совершенно недопустимы побочные реакции и т.д. Поэтому требуется высокая степень чистоты сырья. Так, для производства этилового спирта прямой гидратацией этилена требуется 97-98%-ный этилен, практически свободный от сероводорода (до 0,002 % Н 2 S). Для производства полиэтилена высокого давления требуется 99,99%-ный этилен, совершенно свободный от ацетилена.
Тщательная очистка от сероводорода этилена при получении этилового спирта необходима потому, что ректификационная аппаратура для выделения получаемого спирта из реакционной смеси быстро корродирует и выходит из строя. По этой же причине этилен не должен содержать ацетилена.
При окислении жидких и твердых парафинов до спиртов и кислот необходимо, чтобы в исходном сырье содержалось минимальное количество (до 0,5%) нафтеновых и ароматических углеводородов, тормозящих окисление. Не менее важно отсутствие фенолов, азотистых и сернистых соединений, обрывающих цепь окисления. В связи с этим требования по содержанию серы в ароматических углеводородах являются жесткими (не более 0,02%) и допустимое ее содержание постоянно понижается.
В ряде случаев необходима очистка углеводородного сырья от изомеров и гомологов той же химической природы. Так, если в парафинах имеются углеводороды изостроения, продукты последующего окисления содержат повышенное количество низкомолекулярных кислот, а также изокислот с крайне неприятным запахом.
Примесь диенов в олефинах приводит к развитию смолообразования при изомеризации и алкилировании.
Для углеводородного сырья должны быть ограничения по содержанию оксидов углерода, аммиака и по влажности.
Все выше сказанное говорит о необходимости тщательной подготовки углеводородного сырья.
v Значение предварительной подготовки углеводородного сырья к переработке
Углеводородное сырье должно отвечать высоким требованиям, определяемым спецификой дальнейших химических превращений углеводородов. Одно из основных требований к углеводородному сырью – минимальное содержание или полное отсутствие веществ иной химической природы. Тщательная подготовка углеводородного сырья к переработке необходима для того, чтобы не было коррозии технологического оборудования; увеличивался срок службы катализаторов; исключалась забивка трубопроводов и их пропускная способность; уменьшалось количество побочных продуктов, увеличивался выход целевого продукта и повышалось его качество.
.
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Казанский национальный исследовательский технологический университет»
(ФГБОУ ВО «КНИТУ»)
Кафедра «Технология основного органического и нефтехимического синтеза»
Реферат
по дисциплине «Химия и технология основного органического и нефтехимического синтеза»
на тему «Бутадиен»
Выполнил:
Магистр кафедры ТООНС,
группы 417-М11
Ишмухаметова Л.А.
Казань 2017
Введение……………………………………………………………………….…3
Свойства…………………………………………………………………...4
Применение в промышленности ООНС………………………………...4
Промышленные методы синтеза………………………………………...5
Перспективы производства и применение в России…………………...11
Перспективы производства и применение за рубежом………………..12
Технологическая схема дегидрирования бутана и бутенов…………...13
Введение
Бутадиен-1,3 (дивинил) СН 2 =СН-СН=СН 2 – бесцветный газ с характерным неприятным запахом с темп. кип. 268,59 К.
Бутадиен – типичный диеновый углеводород с сопряженными двойными связями, легко полимеризуется и сополимеризуется со стиролом, нитрилами или эфирами акриловой или метакриловой кислот, винил- и метилвинилпиридинами, винил- и винилиденхлоридами, изобутиленом, изопреном и др. Бутадиен является основным мономером , применяемым в современном промышленном производстве синтетических каучуков. На бутадиене базируется производство подавляющего большинства синтетических каучуков общего назначения: стереорегулярные 1,4,-цис -бутадиеновые, бутадиен-стирольные, бутадиен-метилстирольные, ряд синтетических каучуков специального назначения – бутадиен-нитрильные, бутадиен- метилвинилпиридиновые и др. Помимо производства синтетических каучуков, бутадиен применяется в промышленном масштабе для производства синтетических смол, адиподинитрила (в производстве полиамидов) и себациновой кислоты.
Свойства
Бутадиен-1,3 (дивинил) C4 H6 представляет собой при обычных условиях бесцветный газ, конденсирующийся в жидкость при 268,7 К (-4,3°С), с температурой кипения -4,4°С, температурой плавления - 108,9°С и плотностью в жидком состоянии 0, 645 т/м3 (при 0°С). Не растворим в воде, плохо растворим в спиртах, хорошо - в бензоле, диэтиловом эфире, хлороформе; с некоторыми растворителями образует азеотропные смеси. Критическая температура бутадиена 152°С. С воздухом бутадиен образует взрывчатые смеси с пределами воспламеняемости 2,0 и 11,5% об. Температура вспышки бутадиена составляет -40°С, температура самовоспламенения 420"С.
Бутадиен легко полимеризуется:
nC 4 H 6 →[-CH 2 -CH=CH-CH 2 -]n
Полимеризация инициируется пероксидами, образующимися при контакте бутадиена с воздухом. Тепловой эффект полимеризации зависит температуры и составляет от 72, 8 до 125,6 кДж/моль. Вследствие этого бутадиен хранится в присутствии ингибиторов, например, п-оксидифениламина или п-трет-бутилпирокатехина, которые удаляются промывкой гидроксидом натрия перед полимеризацией. При радикально-цепной сополимеризации бутадиена со стиролом, а-метилстиролом или акрилонитрилом образуются сополимеры, в макромолекуле которых беспорядочно чередуются звенья исходных веществ.
Бутадиен в высоких концентрациях обладает наркотическим действием; в малых концентрациях раздражает дыхательные пути и слизистую оболочку глаз. ПДК составляет 100 мг/м3 .
Применение
Бутадиен является основным мономером, применяемым в современном промышленном производстве синтетических каучуков. На бутадиене базируется производство подавляющего большинства синтетических каучуков общего назначения: стереорегулярные 1,4,-цис-бутадиеновые, бутадиен-стирольные, бутадиен-метилстирольные, ряд синтетических каучуков специального назначения – бутадиен-нитрильные, бутадиен- метилвинилпиридиновые и др. Помимо производства синтетических каучуков, бутадиен применяется в промышленном масштабе для производства синтетических смол, адиподинитрила (в производстве полиамидов) и себациновой кислоты.
Промышленные методы синтеза
Впервые дивинил был получен французским химиком Ж.Б. Каванту в 1862 году пиролизом сивушного масла.
Первое промышленное производство его в СССР было организовано по методу Лебедева из этилового спирта. Этим методом является каталитическое превращение этилового спирта. Он был открыт в 1931 году. Метод Лебедева был заложен в основу промышленного синтеза дивинила в нашей стране. Однако в настоящее время данный метод не находит широкого применения.
В 1949 году В. Реппе открыл метод получения бутадиена-1,3 взаимодействием ацетилена с формальдегидом. С 1940 года начались исследования метода получения дивинила каталитическим дегидрированием н-бутана и н-бутилена Н.Д. Зелинским и А.А. Баладиным, впоследствии успешно внедренного в практику.
Одностадийное дегидрирование н-бутана освоено с 1947 года. В 1980 году в Перми построили установку по выделению бутанов и пентанов из попутных нефтяных газов. Эта установка позволяет получать 50% дивинила из нефтяного сырья.
Метод С.В. Лебедева
2C 2 H 5 OH → C 4 H 6 + H 2 +2H 2 O – 84,8 кДж
Из уравнения видно, что суммарная реакция представляет собой сочетание конденсации, дегидрирования и дегидратации. Этим требованиям отвечает предложенный Лебедевым полифункциональный окисный катализатор, обеспечивающий протекание реакции получения дивинила в одну стадию с технически приемлемым выходом.
Превращение этанола складывается из следующих реакций:
Дегидрирование спирта в ацетальдегид:
CH 3 CH 2 OH → CH 3 CHO + H 2
Конденсация ацетальдегида в альдольм с последующим отщеплением воды и образованием кротонового альдегида:
2CH 3 CHO → CH 3 CH(OH)CH 2 CHO →CH 3 CH = CHCHO + H 2 O
Восстановление карбонильной группы кротонового альдегида с использованием молекулы этанола в качестве гидрирующего агента (последний при этом превращается в ацетальдегид):
CH 3 CH = CHCHO + C 2 H 5 OH → CH 3 CH = CHCH 2 OH + CH 2 CHO
Дегидратация кротилового спирта, сопровождающаяся образованием сопряженной системы двойных связей:
CH 3 CH = CHCH 2 OH →CH 2 = CH-CH = CH 2 + H 2 O
Превращение спирта в бутадиен протекает при 360-380°С на неподвижном оксидном катализаторе. В качестве побочных продуктов образуются органические соединения различных классов: углеводороды, спирты, эфиры, альдегиды и др.
Теоретический выход бутадиена составляет 58,7%, однако, вследствие протекания побочных реакций он обычно бывает несколько ниже, но остается близким к теоретическому. Основным недостатком процесса является низкая селективность. Достоинство способа - сравнительная простота аппаратурного оформления технологического процесса. В настоящее время этот процесс в основном потерял промышленное значение.
Синтез бутадиена по методу Реппе.
Затем при 260-270 0 С в присутствии водяного пара и фосфата натрия(катализатор) на коксе или кусковом графите от тетрагидрофурана снова отщепляют воду; в результате получается бутадиен. Его можно получать и непосредственно отщеплением двух молекл воды от 1,4 – бутиленгликоля в присутсвии фосфорнокислого катализатора, но при этом протекают побочные реакции и получаются худшие выходы, чем при двухступенчатом процессе.
Промышленные способы получения бутадиена из бутана или бутена-1.
Дегидрирование н-бутана до бутадиена-1,3 представляет обратимый гетерогенно-каталитический процесс, протекающий с поглощением тепла через стадию образования изомеров бутилена по схеме:

В промышленности используют различные технологические варианты получения бутадиена дегидрированием углеводородов С 4 . Применяемые процессы можно условно разделить на следующие группы: дегидрирование бутана в бутены, дегидрирование бутенов; одностадийное и двухстадийное дегидрирование бутана в бутадиен. Характерной особенностью реакций дегидрирования с образованием олефинов является ограничение степени превращения условиями равновесия. Реакции дегидрирования всегда являются эндотермическими и, следовательно, равновесие в сторону образования ненасыщенных углеводородов должно сдвигаться с повышением температуры. Степень превращения углеводородов возрастает с повышением температуры и понижением давления. На практике при температурах выше 773-823 К даже в отсутствие катализаторов предельные углеводороды претерпевают реакции изомеризации, крекинга и др. Поэтому процесс дегидрирования бутана проводят при температурах до 923-973 К, т.е. при температурах более низких , чем термодинамические оптимальные. Применение катализаторов позволяет достигнуть высокой скорости процесса при относительно низкой температуре, когда еще не существенен вклад побочных реакций. Ввиду обратимости реакций дегидрирования – гидрирования и, следовательно, способности катализаторов ускорять обратимые реакции в обоих направлениях, эти реакции катализируются одними и теми же соединениями. При дегидрировании вследствие отщепления водорода всегда происходит увеличение объема газа, и понижение давления благоприятствует повышению степени конверсии. По этой причине процессы дегидрирования проводят при давлении, близком к атмосферному, а в некоторых случаях процесс осуществляют в вакууме. Иногда вместо применения вакуума предпочтительнее разбавлять реакционную массу газом, инертным в условиях реакции, или паром, что также приводит к снижению парциальных давлений реагентов и возрастанию равновесной степени конверсии. Снижение парциального давления позволяет также понизить температуру реакции и, следовательно, уменьшить образование побочных продуктов. Важным параметром при проведении реакции дегидрирования является время контакта реакционной смеси с катализатором.
Работы по каталитическому дегидрированию н-бутана по двухстадийному варианту:
н-бутан → н-бутен → бутадиен были начаты в США в 1920-х годах. В Советском Союзе фундаментальные исследования в этой области проводили С.В. Лебедев, Н.И. Шуйкин, А.А. Баландин, Б.А. Казанский и др.
Одностадийное дегидирование бутана в бутадиен
C 4 H 10 ↔ C 4 H 6 + 2H 2 + ∆H, ∆H= 247 кДж
имеет очевидные преимущества перед двухстадийным процессом ввиду отсутствия необходимости разделения газовых смесей после каждой стадии и более низких энерго и капитальных затрат.
Рис. 2 - Зависимость состава равновесной смеси при дегидрировании бутана в бутены и бутадиен от температуры и давления. Сплошные линии - 0,1 МПа, штриховые-0,01 МПа.
1 – бутан; 2 – бутены; 3 – бутадиен
Термодинамические расчеты показывают, что равновесный выход диена существенно возрастает с повышением температуры и с уменьшением парциального давления алкана. Поскольку повышение температуры связано с потерей селективности реакции, одностадийное получение диенов из алканов было реализовано в условиях вакуумного дегидрирования. В одностадийном процессе дегидрирования используют алюмохромовые катализаторы, содержащие 18-30% оксида хрома. Фирма « Гудри» (США) впервые реализовала процесс получения бутадиена из бутана в одну стадию (аналогично процессу получения изопрена из изопентана). В присутствии алюмохромового катализатора протекают побочные превращения бутана, бутенов и бутадиена. Применение алюмохромового катализатора исключает использование водяного пара в качестве разбавителя.
Двухстадийный процесс
дивинила из бутилена дегидрирование бутана в бутилен на хромо-оксидном промотированном катализаторе, нанесенном на оксид алюминия, протекает по реакции:
С 4 Н 10 ↔ С 4 Н 8 +Н 2 ; ΔН= 131 кДж.
В промышленных реакторах протекают и побочные реакции: обратная реакция гидрирования бутилена, крекинг бутана и бутилена, изомеризация бутана и бутилена, реакции углеобразования. На советских промышленных установках по дегидрированию бутана применяют системы с кипящим слоем мелкозернистого алюмохромового катализатора марки К-5. В процессе дегидрирования бутана катализатор покрывается углеродистыми отложениями и изменяет свой химический состав. Активность катализатора при этом резко снижается. С целью реактивации катализатор непрерывно отводят из реактора и обжигают в токе воздуха в регенераторе с кипящим слоем. Углеродистые соединения при этом выгорают, а низшие оксиды хрома окисляются до Сr 2 О 3 . Дегидрирование бутилена до дивинила протекает на хром-кальций-фосфатном катализаторе по реакции:
С 4 Н 8 ↔ С 4 Н 6 + Н 2 , ΔН= 119 кДж.
Бутадиен при повышенных температурах разлагается, поэтому для сохранения достаточно высокой селективности по бутадиену на практике приходится прибегать к снижению парциального давления реакционных газов за счет применения перегретого водяного пара или вакуума. Оптимальная температура сырья на входе в реактор 860-910К. Двухстадийный процесс позволяет создать на каждой стадии оптимальные условия ее протекания, обеспечивающие максимальный выход продуктов и селективность. Для проведения первой стадии широко используются аппараты кипящего слоя. Такие аппараты отличаются целым рядом преимуществ в сравнении с аппаратами, в которых катализатор неподвижно располагается на нескольких тарелках:1)изотермичность слоя, которая достигается благодаря активному перемешиванию; 2) текучесть слоя, в результате которой появляется возможность транспортировки закоксованного катализатора из реактора в регенератор и обратно; 3) высокая поверхность межфазного обмена, в результате высокие скорость теплообмена и массопередачи; 4) низкое гидравлическое сопротивление слоя, обеспечивающее уменьшение энерго затрат и повышающее скорость процесса. Таким образом, в конструкции реактора КС соблюдены все закономерности проведения гетерогенно-каталитических реакций. Процессы дегидрирования и регенерации осуществляются в разных аппаратах одинаковой конструкции. В отличие от первой, вторая стадия протекает в адиабатических реакторах с неподвижным слоем катализатора. Необходимое для реакции тепло подводится с перегретым паром, смешиваемым с сырьем. Достоинство этих аппаратов простота конструкции, недостатки неравномерность распределения температуры в слое, высокое гидравлическое сопротивление аппарата, ухудшение показателей эффективности работы реактора по мере закоксовывания катализатора, периодичность работы аппарата, попеременно работающего то в режиме дегидрирования, то в режиме регенерации. Стадия осуществляется при более высокой температуре и пониженном парциальном давлении, которое достигается при разбавлении бутенов водяным паром. Температура для разных типов катализатора колеблется от 580 до 677 , разбавление паром в соотношении 20:1. Охлаждение контактного газа (закалка) осуществляется впрыскиванием водяного конденсата, дальнейшее охлаждение газа происходит в котле-утилизаторе, затем газ направляется на промывку в скруббер и далее на разделение. Выход бутадиена от массы исходного бутена составляет 20-35%. Селективность колеблется от 73 до 94 %. Достоинствами одностадийного процесса дегидрирования н-бутана до бутадиена-1,3 являются: значительное сокращение расхода технологического пара ; использование теплоты регенерации катализатора и проведение реакции дегидрирования в адиабатическом режиме и, как следствие, простота конструкции реактора и отсутствие сложного теплообменного оборудования; исключение второй стадии дегидрирования и операций разделения бутанбутиленой фракции. За счет этого относительно невысокие выход бутадиена-1,3 (12-14%) и степень конверсии н-бутана (не превышающая 0,2) компенсируются меньшими капитальными затратами и энергоемкостью производства и, как следствие, более низкой, чем в двухстадийном методе, себестоимостью бутадиена-1,3. Соответственно, проанализировав выше написанное, можно увидеть, что метод двухстадийного дегидрирования бутана энергоемкий и требует сложной технологической схемы. Для промышленной реализации это невыгодно, так как потребуются значительные энергозатраты. Поэтому появилась необходимость поиска альтернативного способа дегидрирования. Оказалось, что этот процесс может быть осуществлён и по одностадийной схеме, хотя термодинамика процесса устанавливает четкий предел выхода целевого продукта. Но при повышении температуры и понижении давлении можно достичь хороших результатов и по этой схеме. В данной статье как вариант решения проблемы рассмотрен способ дегидрирования под вакуумом, изобретенным в США в фирме Гудри. Как оказалось, данный метод имеет ряд преимуществ и дает хороший выход продукта. Для увеличения выхода целевых продуктов, увеличения селективности и снижения материальных затрат, необходимо проведение дальнейших исследований влияния глубины вакуума на процессы дегидрирования бутанов и бутиленов.
Перспективы производства и применение бутадиена в России
Основное направление потребления бутадиена в России – производство каучуков различных марок (дивинилстирольные, бутадиеннитрильные, полибутадиеновые и др.); незначительное количество бутадиена используется в производстве акрилонитрилбутадиенстирольных пластиков (АБС-пластиков), дивинилстирольных термоэластопластов, латексов. Практически каждый крупный производитель имеет собственную сырьевую базу на основе фракционирования.
Процессы, разработанные для получения бутадиена как целевого продукта, - это дегидрирование бутана или бутена, а также выделение бутадиена из фракции С 4 крекинг-газов (БДФ). Основные производители бутадиена методом выделения целевого продукта – ОАО «Нижнекамскнефтехим», ОАО «Омский каучук», ООО «Тольяттикаучук» и ЗАО «Каучук» (г. Стерлитамак).
Метод дегидрирования бутана внедрен на двух предприятиях в России – в ОАО «Тобольский НХК» и ООО «НКНХ-Дивинил». Реализованная технология, несмотря на свою историческую зрелость, крайне востребована на российском рынке. Обусловлено это двумя основными факторами: устойчивой тенденцией роста производства сжиженных газов – сырьевой базой, и положительной тенденцией роста производства синтетических каучуков – потребителей бутадиена. Таким образом, «НКНХ-Дивинил» является не только производителем одного из ключевых мономеров в нефтехимическом ряду «сжиженные газы» – резины, но и значительным потребителем (до 175 тыс. т/год) бутана нормального. Кроме того, технологические мощности установок ЦГФУ, входящих в состав «Нижнекамскнефтехима», позволяют осуществлять выделение целевого вида сырья (бутана нормального) из фракций бутана технического и др.
В 2007 году в России было произведено 404,1 тыс. т бутадиена: 54% по методу одностадийного дегидрирования н-бутана, 46% - извлечением из пиролизной фракции. В 2009 г было выработано 409,7 тыс. т, а в 2011, за счет увеличения мощностей практически на всех российских предприятиях удалось достигнуть значения 483,9 тыс.т/г бутадиена. Но даже при такой выработке ежегодный дефицит бутадиена в 2012 году составляло около 200 тыс.т/г, что сказалось на производстве всех видов бутадиенсодержащих продуктов. В условиях сложившегося сырьевого кризиса в индустрии бутадиена цены на бутадиен выросли более чем в 2 раза. Цена реализации бутадиен – 1,3 производства ОАО «Тобольск-Нефтехим» по состоянию на март 2012 г. составляла не менее 100 тыс. руб./тонна. Остальные российские производители не имели товарной выработки бутадиена , весь получаемый ими продукт расходовался на собственное потребление.
Перспективы производства и применение бутадиена за рубежом.
За рубежом широко применяют процессы получения бутадиена из н-бутана и/или бутан-бутиленовой фракции, а изопрена - из изопентана и/или изопентанизоамиленовой фракции, что является процессом каталитического дегидрирования углеводородов - процессом «Катадиен» фирмы-разработчика «Air Products and Chemicals» (США). Модификации процесса «Катадиен» проведены фирмой «ABB Lummus Crest» (США).
Наибольшими мощностями в 2003 г. обладали следующие страны (тыс. т/г.): США - 2592, Япония - 1012, Китай - 768, Южная Корея - 724, Германия - 505, Франция - 420. Крупнейшим заводом бутадиена в мире является предприятие фирмы «Хантсман» в г. Хьюстон (США) - 544 тыс. т. в год. Ожидается, что в течение 2001-2006 гг. в Северо-Восточной Азии войдет в строй свыше 580 тыс. т новых мощностей.
Технологическая схема дегидрирования бутана и бутенов
Очищенная бутановая фракция из сепаратора 9 поступает в испаритель 10. Пары углеводорода перегреваются сначала в пароперегревателях 8 до 275 0 С, а затем – трубчатой печи 2 – до 530 – 550 0 С. Из печи перегретые пары бутана при давлении 1,5 ат направляются в реактор 7 с кипящим слоем катализатора. Дегидрирование проводят при 580 С. Для достижения этой температуры из регенератора 6 в реактор непрерывно подают катализатор, нагретый до 640 - 650°С. Температуру в реакционной зоне регулируют, изменяя кратность циркуляции катализатора (обычно кратность циркуляции колеблется в пределах 14-20). Таким образом, в данном процессе катализатор является и теплоносителем. Контактные газы из реактора, пройдя пароперегреватели 8 и испарители 10, промываются водой в скруббере 11 и охлаждаются. В сепараторе 13 контактный газ отделяют от тяжелых углеводородов и направляют на разделение.
Отработанный катализатор на выходе из нижней части реакторатобрабатывают азотом для десорбции углеводородов. По пневмотранспортной трубе мелкозернистый катализатор с помощью воздуха направляют в регенератор б. В регенераторе углистые отложения на поверхности катализатора выжигаются кислородом воздуха в кипящем слое. Однако тепла, выделяющегося при сгорании углистых отложений, недостаточно для подогрева катализатора до требуемой температуры (≈650° С). Поэтому в регенератор через форсунки вводят топливный газ, при сгорании которого выделяется дополнительное тепло.
Регенерированный катализатор проходит десорбер, где продувается бутаном для удаления адсорбированного кислорода и дополнительного восстановления шестивалентного
хрома в трехвалентный. Для этих целей расходуют от 3 до 5% подаваемого на процесс бутана; бутан из десорбера используют как топливо, подаваемое на сжигание в регенератор. Физическое тепло отходящих из регенератора газов используют в котле-утилизаторе 5 для получения водяного пара. Катализаторная пыль, увлекаемая газами из регенератора, увлажняется в аппарате 4 и оседает в электрофильтре 3.
Список использованной литературы
И.П. Мухленов, Катализ в кипящем слое.- Л.: Химия, 1917.
А.А. Назаров, Д.Ф. Юлбарисов, С.И. Поникаров, Получение бутадиена дегидрированием бутанов и бутадиенов
А.П. Писаренко, З.Я. Хавин, Курс органической химии. – М.: Высшая школа, 1968.
С.К. Огородников, Справочник нефтехимика. В двух томах. Т. 2. – Л.: Химия, 1978. – 592 с.
А. Рихе, Основы технологии органических веществ. – М.: Государственное научно-техническое издательство химической литературы , 1959.
А.Г. Лиакумович, Р.А. Ахмедьянова, Т.М. Богачева, К.В. Голованова, Современное состояние индустрии бутадиена – 1,3 и продуктов на его основе. Проблемы и перспективы. 2012